1946년 3월 23일, 미국의 물리화학자 ‘산-염기, 원자가이론, 열역학의 개척자’ 길버트 뉴턴 루이스 (Gilbert Newton Lewis, 1875 ~ 1946) 별세
길버트 뉴턴 루이스 (Gilbert Newton Lewis, 1875년 10월 23일 ~ 1946년 3월 23일)는 미국의 물리화학자이다. 루이스에 의해 확립된 전자쌍 이론은 공유 결합의 이해와 산과 염기에 대한 정의의 확장에 큰 영향을 끼쳤다.

– 길버트 뉴턴 루이스 (Gilbert Newton Lewis)
.출생: 1875년 10월 25일, 미국 매사추세츠 와이머스
.사망: 1946년 3월 23일, 미국 캘리포니아 버클리
.국적: 미국
.부모: 메리 버 화이트 루이스, 프랭크 웨슬리 루이스
.자녀: 리차드 뉴튼 루이스, 에드워드 S. 루이스, 마저리 루이스 셀비
.학력: 하버드 대학교, 매사추세츠 공과대학교
.업적: 루이스 구조식
미국 매사추세츠주의 웨이머스에서 출생하였다. 1899년 하버드 대학교에서 박사학위를 취득하였고, 이후 라이프치히와 괴팅겐에서 수학하였다. 그 후 하버드 대학교의 강사로 있다가 1905년 케임브리지에 위치한 매사추세츠 공과대학교에서 열역학에 대한 연구를 시작하였다. 1907년 매사추세츠 공과대학교의 조교수, 1911년 정교수가 되었으며 1912년 그는 캘리포니아 대학교 버클리의 물리화학 교수이자 화학 대학의 학장을 맡게 되었다.
그는 1908년 활동도에 대한 개념을 도입하여 열역학의 기초를 마련하였다. 1916년경부터 옥텟 규칙, 전자쌍 결합 이론, 루이스 산 등의 개념들을 화학 결합에 도입하기 시작하였고 그 후 카복시산의 해리도에 대한 치환기의 영향에 대해서 설명을 시도하였다.
1933년 그는 중수소를 분리하여 순수한 중수를 만들어 냈다. 말년에 그는 색소에 대한 광화학적 연구를 시작하였고, 인광이 발생하는 이유가 삼중항 상태에 있다는 것을 밝혀내기도 하였다. 1946년 캘리포니아주의 버클리에서 사망하였다.

○ 생애 및 활동
고등학교 다닐 때 화학을 공부하였던 사람들은 20세기에 가장 뛰어난 화학자들 중의 한 사람인 길버트 루이스 (Gilbert Newton Lewis: 1875~1946)의 이름을 한번쯤 들어본 적이 있을 것이다. 그는 1900년대에 화학열역학, 공유결합의 전자쌍 모델 (루이스 전자점 구조), 산염기이론, 중수소와 중수소화합물의 연구와 분리, 인광과 삼중항상태 연구 등으로 화학발전에 크게 기여한 미국의 물리화학자이다.
그뿐만 아니라 루이스는 1912년부터 캘리포니아 대학교 버클리캠퍼스 (University of California, Berkeley)에서 34년간 재직하면서 마치 서부개척시대를 방불케할 정도로 알려지지않은 버클리 화학과를, 세계적으로 유명한 화학과로 성장하도록 만든 일등공신이다. 그러나 정작 본인은 35번이나 노벨상 수상자로 지명되면서도 그의 제자들 여러명이 수상한 노벨상을 끝내 타지 못하였다.
분명 노벨상이 위대한 업적의 상징이긴 하지만, 그 역사를 들여다 보면, 반드시 최고의 업적을 이룬 사람만이 수상을 하게 되는 것은 아니라는 것을 알 수 있다. 세상 사는 이치는 어디서건 마찬가지여서 “어떻게 하면 루이스처럼 노벨상을 타지 못하는가”에 대해 알아보는 것도 장래의 노벨상 후보자들을 위하여 의미 있는 일인 것 같다.
- 어린 시절
루이스 (Gilbert Newton Lewis)는 매사추세츠주 웨이머스 (Weymouth, Massachusetts)에서 1875년 태어났다. 그는 변호사인 독립적인 성격의 아버지 (Frank Wesley Lewis)와 어머니 (Mary Burr White Lewis)로부터 집에서 재택교육을 받았다. 1884년 그의 가족은 네브래스카주, 링컨 (Lincoln, Nebraska)으로 이사를 하였으며, 루이스는 1889년 14살이 되어서야 네브래스카 사립학교에 진학하여 처음으로 정규교육을 받게 된다. 그는 어릴 때 재택교육을 받은 영향 때문인지, 폐쇄적인 환경 바깥에서는 결코 편안하지 않았다. 만일 누가 아주 작은 무시라도 했다면 그는 뒤끝 작렬이어서 평생 동안 그 사람에게 유감을 가졌다.
루이스는 고등학교를 졸업하고, 네브래스카 대학에 진학해서 2년을 다닌 후, 1893년 하버드대학으로 편입해 1896년 학사학위를 받았다. 졸업 후 1년 동안 엔도버의 필립스 아카데미 (Phillips Academy, Andover)에서 가르친 후 박사과정을 하기위해 하버드로 돌아온다.
- 하버드, 마닐라, MIT 시절
루이스는 테오도르 리차즈 (Theodore William Richards)의 지도아래 “아연과 카드뮴 아말감들의 몇 가지 전기화학적 열역학적 관계 (Some electrochemical and thermochemical relations of zinc and cadmium amalgams)”라는 제목의 학위논문을 써서 1899년 박사학위를 받았다. 그의 지도교수 리차즈는 수많은 화학원소들의 원자량을 정밀하게 측정한 공로로 미국 최초의 노벨상을 1914년 수상한 인물이다. 리차즈는 루이스에게 실험기술과 정밀한 측정방법을 가르쳤을 뿐 아니라 열역학에 대한 흥미를 길러주었다. 루이스의 대부분의 지속적인 관심주제들은 하버드대학 시절에서 비롯되었으며 가장 중요한 분야가 열역학으로 그 당시 리차즈가 매우 왕성하게 연구하던 주제이다.
이론보다는 입증할 수 있는 사실이 더 중요하다는 패러데이의 방법에 대한 리차즈의 신념이 루이스의 연구 접근 방식에 영향을 끼쳤다. 무척 총명하고 조숙한 청년 루이스는 또한 수줍고 자신감이 부족하였다. 그의 아이디어는 아마도 부분적으로는 남과는 다른 교육 때문이었던지 정통적이 아니며 특이하였다. 루이스는 자신의 재능의 진가를 특히 리차즈가 알아보지 못한다고 실망하고 분노하여 지도교수와 갈등관계에 놓였다. 후일 1928년 리차즈가 사망한 후 하버드 대학에서 후임으로 물리화학 교수직을 루이스에게 제안하였으나 거절하였고, 1929년 명예박사 학위까지 거부하였다.
여하튼 그는 박사학위후 하버드 대학에서 강사로 1년간 가르친 후 펠로우쉽을 받아 1900~1901년 까지 당시 물리화학의 성지였던 독일로 가서 라이프치히 (Leipzig)의 오스트발트 (Wilhelm Ostwald) 그리고 괴팅겐 (Göttingen)의 네른스트 (Walther Herrmann Nernst)와 각각 한 학기씩 보낸다. 루이스는 네른스트 실험실에서 일하는 동안 그에게 평생 동안 가는 적대감을 갖게 된다. 그는 하버드로 돌아와 열역학과 전기화학 과목을 3년 가르친 후, 필리핀으로 가서 도량형국의 관리자로 1년간 일하였다.
1905년 루이스는 미국으로 돌아와 MIT의 노이스 (Arthur Amos Noyes) 물리화학 그룹에 합류하였다. 라이프치히의 오스트발트 지도아래 박사학위를 받은 노이스는 미국에서 물리화학의 발전에 강력한 영향을 끼쳤다. 루이스는 여기에서 이론과, 실험 양쪽 방면에서 열정적으로 연구 활동을 하면서 7년을 보냈으며, 열역학에서 자신의 연구의 토대를 쌓았다. 바로 이 기간 동안 “열화학의 새로운 시스템의 개요 (1907)” 와 “화학물질들의 자유에너지” 같은 획기적 논문들을 출판한다. 이제 유명해진 루이스는 MIT에서 초고속으로 1907년 조교수, 1908년 부교수, 그리고 1911년에 정교수가 되었다.
그는 1912년 MIT를 떠나 캘리포니아대학교 버클리 캠퍼스의 물리화학교수이자 화학대학의 학장으로 자리를 옮겼다. 그후 버클리 캠퍼스에서 34년 재직하면서 위상이 형편없던 버클리 화학과를 미국에서 최상급 수준의 화학과로 탈바꿈시켜 놓았다. 그의 제자들 중 유리 (Harold Urey: 1934), 지오크 (William Francis Giauque: 1949), 시보그 (Glenn Theodore Seaborg: 1951), 리비 (Willard Frank Libby: 1960)가 노벨 화학상을 수상했다.
버클리에서의 루이스의 연구는 세계 제 1차 대전으로 잠시 중단된다.
1918년 1월 루이스는 화학전 부대의 소령으로 참전하여 프랑스로 가서 전쟁이 끝날 때 까지 복무하였다. 마지막 두 달은 중령으로 진급해 워싱톤에서 화학전 훈련부장으로 일하였으며 1918년 9월에 다시 학교로 돌아왔다. 그는 전쟁중 공적을 인정받아 프랑스 정부로부터 십자 명예훈장 (Cross of the Legion of Honor)을, 미 의회로부터 공로훈장(Distinguished Service Medal)을 받았다.

- 열역학
1895년 까지 대부분의 중요한 열역학 관계식들이 다 알려져있긴 했지만, 한 관계에서 다른 관계식을 알아낼 수 있는 논리적인 체계는 아직 합리적으로 발전되지 않아 관계식들은 마치 독립된 것들로 보였다.
더구나 이들 관계식들은 단지 이상적 화학 시스템에만 적용이 되는 불완전한 것이었다. 1907년 루이스는 활동도라는 새로운 개념에 근거한 열역학 체계를 만들었다. 농도의 단위로 표시되는 함수, 활동도는 화학시스템에서 변화를 일으키는 물질의 경향을 나타낸다. 그는 퓨개시티 (fugacity) 라는 아이디어를 일반화하여 활동도를 유도하였으며, 자유에너지의 변화가 활동도의 변화에 비례하므로 자유에너지로부터 직접 유도할 수 있다는 것을 강조하였다. 루이스는 모든 익숙한 이상계 (ideal system)에 대한 열역학적 식들이 활동도를 사용하면 실제계 (real system)에 대해 “완벽하게 일반적이 된다는 것을” 보여주었다. 그는 또한 분몰양 (partial molal property)이라는 중요한 새로운 개념을 정의하였다.
전반적으로 열역학에 대한 루이스의 주된 기여는 거창한 이론이 아니라 오히려 실제 시스템에 대한 열역학의 실질적인 적용에 있다. 1913년부터 1920년 사이, 루이스는 주로 랜들 (Merle Randall)과 함께 각 원소에 대한 모든 알려진 자유에너지와 엔트로피 자료를 체계적으로 수집하고 다시 재정리하여 일련의 긴 논문들을 출판하였으며 이 자료들은 모두 그의 책 “화학물질의 열역학과 자유에너지 (Thermodynamics and Free energy of Chemical Substances)”의 내용이 되었다. 이 책은 화학 열역학을 무척 명료하고 간단하게 제시하여 몇 세대에 걸쳐 가장 영향력 있는 교과서가 된다.
- 원자가이론
G. N. 루이스는 안정된 화합물에서는 원자를 둘러싸는 최외각에 8개의 전자가 배치된다고 하는 팔우설을 제창하였는데, 랭뮤어는 이 팔우설을 더욱 발전시켰다. 1902년 루이스는 화학결합에 대한 강의에서 아직 다듬어지지 않은 “정육면체 원자” 라는 아이디어를 처음으로 사용하였다. 그는 원자의 외각 (Outer shell)을 정육면체로 상상하고 비극성 원자나 분자에서 전자들은 정육면체의 여덟 개 정점을 점유한다고 생각하였다. 이 “정육면체 원자모형 (cubic atom model)”은 주기율표에서 8개 원소들이 한 주기를 이루는 것을 설명할 수 있었다. 아래 그림은 주기율표의 두 번째 줄에 있는 원소들의 구조를 정육면체 원자 모델로 나타내고 있다.
이 설에 의하면 이온 결합의 형성은 모서리를 공유하지 않고 한 정육면체에서 다른 정육면체로 전자가 이동할 때 생긴다. 가령 플루오린 원자는 최외각에 7개의 전자를 갖고 있어 아주 쉽게 다른 원자로부터 전자 한 개를 얻어 네온과 같은 안정한 전자배치를 하게 된다. 아래 그림에 정육면체 원자모형의 결합을 나타내었다.
한편 단일 공유결합은 두 원자가 두 모서리를 공유할 때 생기며, 루이스는 중간상태는 단지 한 모서리가 공유될 때라고 가정하였다. 이중결합은 두 정육면체 원자들 사이에서 면을 공유할때 생기며, 삼중결합은 이 모델로는 설명할수 없다.
루이스는 정육면체 원자모형을 1902년에 출판하지 않았지만, 이 이론을 더욱 발전시켜 1916년 “원자와 분자의 화학결합”이란 고전적 논문을 발표하였다. 이 논문에서 공유된 전자쌍으로 이루어진 공유결합이라는 아이디어를 처음 제안하였으며 정육면체 원자 모델뿐만 아니라 ”루이스 점 구조 (Lewis dot structure)”도 발표하였다. 또한 전자가 공유되지 않을 때 현대적 용어로 자유라디칼에 해당하는 “홀수전자분자 (odd molecule)”라는 용어도 만들어 내었다. 아래에 CO2 분자의 루이스 점 구조를 그리는 간단한 방법을 실었다.
그러나 루이스의 전자쌍 공유결합 이론은 거의 3년 이상 아무런 주목을 받지 못하고 완전히 무시되었다. 세계 제일차대전이 끝난 직후 1919년 제네럴 일렉트릭 (General Electric) 회사에서 일하던 물리화학자 랭뮤어 (Irving Langmuir)가 루이스 이론의 중요성을 충분히 깨닫고 정육면체 원자와 공유쌍 결합에 대한 주제를 다루기 시작하였다. 1919년부터 1920년 사이, 미국화학회에서 그리고 그 후 여기저기 초청을 받아 행한 랭뮤어의 극적인 강연을 통하여 새로운 “루이스-랭뮤어 원자가이론”은 갑자기 미국 화학자들의 관심을 불러일으켰다. 랭뮤어는 1919년에서 1921년까지 발표한 여러 편의 긴 논문들과 강연을 통해 루이스의 이론을 아주 성공적으로 설명하고 발전시켰다. 따라서 그 이론은 많은 사람들에게 루이스-랭뮤어의 원자가 이론 (Lewis-Langmuir theory of valence) 또는 랭뮤어의 원자가 이론 (Langmuir theory of valence)으로 알려지게 되었다.

- 루이스 산-염기 이론
브뢴스테드-로우리 산염기모델 (Brønsted-Lowry acid-base theory)에서는 다른 물질에게 양성자를 내주는 물질 (Proton donor)은 산 이고, 다른 물질로부터 양성자를 받는 물질 (Proton acceptor)을 염기라고 정의하였다
그러나 이 이론은 매우 제한적이어서, 1923년 루이스는 이를 대체하는 루이스의 산염기 모델 (Lewis acid-base theory)을 제안하였다. 루이스는 이 모델에서 공유결합을 형성하기 위해서 양성자대신 전자쌍을 줄 수 있는 물질을 염기 (electron donor, 전자주개) 그리고 전자쌍을 받는 물질을 산 (electron acceptor, 전자받개)이라고 정의하였다. 그의 산-염기 이론은 구조와 결합에 근거를 두고 산과 염기를 더보편적으로 설명할 수 있었으며, 화학자들은 이제 좀 더 넓고 다양한 산-염기 반응을 예측할 수 있게 되었다. 예를 들면 위 BF3 와 NH3 반응에서, BF3 는 루이스 염기인 NH3로부터 비공유 전자쌍 (lone pair of electrons)을 받아 최외각의 비어있는 전자궤도를 채우는 루이스산으로 작용한다.
- 루이스 구조식
루이스 전자점식과 구조식이 있는데 이 둘은 결합선의 유무에 달려 있다.
화합물은 입체적으로 되어있다. 하지만, 2차원의 평면상에서는 화합물의 구조를 그대로 그리기란 거의 불가능하다.
그래서 화합물들 좀 더 편리하게 그리기 위해, 루이스 구조식, Lewis 구조식을 사용하여 나타낸다.
루이스 구조를 그리려면 다음과 같은 규칙을 지켜나가며 그려야 하는데 그 규칙들은 아래와 같다.
- 결합순으로 구성 원자를 나열한다. 이 때, 구조는 미리 알고 있거나 예측을 해야한다.
- 전체 원자가 전자수 계산
- 이온결합 화합물은 양이온과 음이온을 따로 표시함.
- 결합 원자 사이에 전자 한 쌍을 배치하고, 전체 원자가 전자수가 짝수면 항상 짝으로 배치한다.
- 외각 원소에 쌍으로 8개까지 전자를 배치한다.
- 나머지 전자는 중심원소에 쌍으로 배치한다.
- 중심원소가 8개 미만의 전자를 가지면 외각 원소에 배치된 전자를 가지면 외각 원소에 배당된 전자를 중심원소가 8개의 전자를 갖도록 원자 사이로 이동시켜, 다중 결합을 만든다.
- 3주기 원소 (P, S)는 8개의 이상을 전자를 가질 수 있고, B, Al 원소는 8개의 이하의 전자를 가질 수 있으며, 2주기 원소(C,N,O)는 8개 까지만 소유가 가능하다. 8개보다 적은것은 괜찮으나, 많은 것은 절대로 불가하다.
- 사망
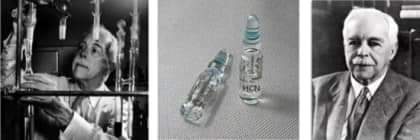
1946년 3월 23일 토요일 오후, 루이스는 지난 30여 년간 매일 같이 드나들던 실험실에서 액체수소 시안화물의 전도상수와 온도와의 관계에 대한 실험을 하다 갑작스러운 심장마비로 병원으로 옮기던 중 사망했다.
화학자는 영혼을 잃어버릴 수는 있어도 용기를 잃어버릴 수는 없다. 만일 화학자가 지옥으로 떨어지면서 끓는 용광로의 유황냄새를 맡게 된다면, 아마 다음과 같이 말할 것이다. “‘지옥의 사자여, 나에게 실험관을 주시오’라고.” – 루이스의 대중 강연 중에서.
○ 주요저서
Thermodynamics and the free enertgy of Chemical Substances (1923년, 멀 랜달과 공저)
Valence and Structure of Atoms and Molecules (1923년)
Anatomy of Science (1926년)
참고 = 위키백과, 나무위키
크리스천라이프 편집부

